輝瑞新冠口服藥進入中國市場,國內藥企相關產品上市指日可待
日前,我國國家藥監局附條件批準了美國輝瑞公司新冠病毒治療藥物奈瑪特韋片/利托那韋片組合包裝(即Paxlovid)進口注冊,這意味著國內也終于有了第一款口服新冠藥物。
而根據博騰股份(300363)此前公告顯示,公司與輝瑞達成新一批采購訂單,規模達6.81億美元。許多券商從合同信息及行業近況判斷,估計此次訂單為新冠口服小分子藥物Paxlovid的中間體生產外包訂單,直供輝瑞旗下工廠,預計將顯著提升公司業績。
新簽訂單規模超預期
國家藥監局官網顯示,Paxlovid為口服小分子新冠病毒治療藥物,用于治療成人伴有進展為重癥高風險因素的輕至中度新型冠狀病毒肺炎(COVID-19)患者,例如伴有高齡、慢性腎臟疾病、糖尿病、心血管疾病、慢性肺病等重癥高風險因素的患者。
同時,根據不完全統計,Paxlovid已在美國、英國、以色列、加拿大等全球多個國家/地區被批準上市或授權緊急使用。輝瑞此前披露,將持續加大Paxlovid的生產和分銷投入,預計在2022年底將提供1.2億個療程的藥物。
就在國家藥監局宣布附條件批準Paxlovid進口注冊前一天,博騰股份作為國內首家上市的CMO服務商,發布公告稱近日收到輝瑞的新一批《采購訂單》,公司將為其提供合同定制研發生產(CDMO)服務。博騰股份新獲得訂單金額合計6.81億美元(約合43億元人民幣),接近于公司一年營收的1/3,全年凈利潤的兩倍。目前該訂單已生效,且交付日期為2022年,將確保博騰股份2022年業績加速增長。
為滿足訂單要求,博騰股份加大擴建力度,加速產能釋放。2021年6月,博騰股份109車間正式投產,新增產能186.68平方米;同年8月,公司又收購宇陽藥業70%股權,宇陽藥業擁有4個車間,產能合計約580平方米,合計產能擴大至2000平方米,為業務發展和快速增長奠定堅實基礎,有力支撐公司產能釋放。
而近日,隨著持續獲得大訂單,博騰股份于2022年2月又新擴建301車間,新增產能142.6平方米,定位為中等商業化規模的GMP中間體柔性產能,將于2023年投入運營,滿足不同項目的需求,實現項目間的高效切換。
目前,市場普遍認為博騰股份是CDMO二線,但更多券商則表示,博騰經過兩年持續且深入的CDMO戰略轉型,公司的技術能力和技術儲備、客戶覆蓋深度廣度等均已逐步向一線靠攏,差距越來越小,行業影響力在加速擴大,本次重大合同的簽訂讓公司技術和服務能力得到進一步肯定,充分表明中國醫藥制造供應鏈的全球領先性。
國內在研新冠藥進展良好
而隨著Paxlovid附條件獲批注冊,除了博騰股份備受關注以外,國產新冠口服藥研發進程也頗受市場關注。
據不完全統計,目前國內至少11款在研的新冠病毒口服藥。其中,進展最快的是君實生物研發的VV116和開拓藥業的普克魯胺。
據覽富財經網此前報道的《國內首款新冠口服藥正推進臨床試驗,君實生物等上市公司受到關注》一文中就提到,君實生物研發的VV116就已經在烏茲別克斯坦獲得了緊急使用授權,目前正在準備該藥物國際多中心二、三期臨床試驗。
截至目前,該藥品又有了新的進展,VV116現正在開展全球多中心臨床研究,其中3項在中國開展的I期研究已于2022年1月完成。初步結果顯示,VV116的臨床安全性良好,這也是目前國內唯一獲批進入臨床試驗階段的新冠小分子藥物,有望在2022年下半年遞交新藥上市申請。
另外,開拓藥業在研的普克魯胺新冠口服藥屬于新一代雄激素受體拮抗劑,于2021年7月獲得巴拉圭的緊急使用授權,并且在海外開展的多中心臨床試驗已經接近尾聲。不過,普克魯胺III期臨床試驗中期分析未達預期。目前,開拓藥業正在尋求FDA的同意,對臨床方案進行調整,繼續對美國市場發起沖擊。
2月11日,開拓藥業公告稱,普克魯胺治療輕中癥新冠患者全球多中心III期臨床試驗(NCT04869228)已在深圳市第三人民醫院完成中國首例受試者入組及給藥。開拓藥業在公告還提到,普克魯胺針對重癥住院新冠患者的臨床試驗(NCT05009732)已在美國、烏克蘭、菲律賓全面啟動患者入組,目前正在中國臨床中心進行患者入組前的篩選,其他參與全球多中心臨床試驗國家的相關工作也在積極推進中。
業內人士表示,口服藥是終結疫情武器之一,新冠口服藥的上市意味著多了一種抗疫手段。除上述企業外,國內還有多家藥業紛紛布局,為全球疫情貢獻中國力量。
責任編輯:hnmd003
相關閱讀
-
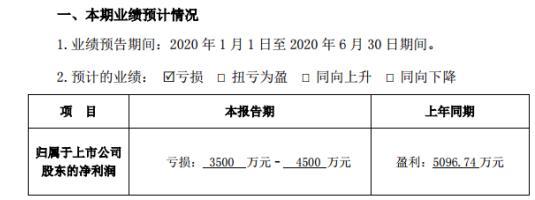
金固股份:2020年預計虧損3500萬元–4500萬元
7月14日消息,金固股份(002488)發布2020年半年度業績預告:去年預計虧損3500萬元–4500萬元,上年...
2020-07-27 -

成都路橋(002628)急速拉升0.18元,漲幅4.43%
2020年07月08日,成都路橋(002628)急速拉升0 18元,漲幅4 43%,成交量1492 93萬股,成交額6155 53萬...
2020-07-23 -
07月21日富國創業板B上漲5.40%,成交17005.69萬元
07月21日富國創業板B上漲5 40%,成交17005 69萬元。截至目前場內價格為1 639元, 當前本基金場外凈...
2020-07-21 -
輝瑞新冠口服藥進入中國市場,國內藥企相關產品上市指日可待
日前,我國國家藥監局附條件批準了美國輝瑞公司新冠病毒治療藥物奈瑪特韋片 利托那韋片組合包裝(即Pax...
-
俄總統普京簽發征召預備役人員進行軍訓的命令
04:44【俄總統普京簽發征召預備役人員進行軍訓的命令】財聯社2月19日電,俄羅斯總統普京于當地時間2月18...
-
財聯社2月19日電,巴西衛生部稱再次收到110萬支輝瑞疫苗。
此頁面是否是列表頁或首頁?未找到合適正文內容。
-
世衛組織:全球累計新冠肺炎確診病例超4.1865億例
05:28【世衛組織:全球累計新冠肺炎確診病例超4 1865億例】財聯社2月19日電,根據世衛組織最新實時統計...
-
美股三大指數集體收跌 熱門中概股多數下行
05:00【美股三大指數集體收跌熱門中概股多數下行】財聯社2月19日電,美股三大指數集體收跌,道指跌0 68...
-
海南:已有逾34萬個場景開展數字人民幣試點
12:36【海南:已有逾34萬個場景開展數字人民幣試點】財聯社2月14日電,據”海南發布“微信公眾號,作為...
-
江蘇蘇州新增7例新冠肺炎確診病例
12:34【江蘇蘇州新增7例新冠肺炎確診病例】財聯社2月14日電,蘇州市2月14日召開疫情防控新聞發布會,介...
-
財聯社2月14日電,消息稱,日本方面同意在第一季度購買額外的1000萬劑輝瑞疫苗。
此頁面是否是列表頁或首頁?未找到合適正文內容。
-
聯想、農夫山泉納入恒生指數 恒大物業被剔除恒生中國企業指數
中新經緯2月18日電恒指公司公布2021年第四季度季檢結果,聯想、農夫山泉獲納入恒生指數,成份股數目將由...
-
官方通報2022年第一批侵害用戶權益APP 速8酒店等在列
中新經緯2月18日電據“工信微報”微信公眾號18日消息,工信部通報2022年第一批侵害用戶權益的APP,速8酒...
-
正榮:資源不足以支付2億美元永續債 還將嘗試重組其他境外債
觀點網訊:2月18日,正榮地產集團有限公司發布公告稱,公司資源不足以支付2億美元永續債,正嘗試征求證...
-
普利制藥:注射用鹽酸萬古霉素獲哥斯達黎加上市許可
18:31【普利制藥:注射用鹽酸萬古霉素獲哥斯達黎加上市許可】財聯社2月16日電,普利制藥公告,公司近日...
-
雅化集團:Core公司預計今年四季度將按協議約定為公司提供鋰精礦
18:33【雅化集團:Core公司預計今年四季度將按協議約定為公司提供鋰精礦】財聯社2月16日電,雅化集團公...
-
游族網絡:股東林奇所持3.88%股份擬被動減持
18:33【游族網絡:股東林奇所持3 88%股份擬被動減持】財聯社2月16日電,游族網絡公告,接到股東林奇先...
-
順豐控股1月營業收入251.13億元 同比增長53.27%
觀點網訊:2月18日晚間,順豐控股股份有限公司披露2022年1月快遞物流業務經營簡報。觀點新媒體獲悉,于2...
-
特斯拉又惹上事?涉嫌虛報續航里程數 韓國正考慮重罰
財聯社(上海編輯劉蕊)訊,當地時間周三,韓國一名官員表示,韓國反壟斷監管機構認為特斯拉夸大了其產...
-
上投摩根趙隆隆:新能源汽車估值性價比已經凸顯 重點挖掘競爭力更強的公司
過去兩年間,新能源行業無疑是整個市場表現搶眼的“王者”。然而,從去年4季度以來,該賽道出現了一波顯...
-
蘑菇街心動直播節:設計感兼性價比的小香風外套火了
年味兒意猶未盡,情人節接踵而至,擦出“浪漫消費”新火花。年輕女性熱衷時尚且追求性價比的理念,讓設...
-
騙子的新套路,警惕“元宇宙”背后的非法集資風險!
近一段時間以來,元宇宙成為科技和投資領域的熱詞,多家知名機構爭相布局這一流行賽道,市場對于元宇宙...
-
京東騰訊阿里小米都捐款了!香港疫情突然嚴峻!內地全力支援
單日新增確診超3600例!近期,香港疫情在短時間內急劇惡化,新增確診及初篩陽性數字均破新高,累計確診...
-
早點下班!微信試水早十晚六:只因應屆生向張小龍反映太卷?
2月18日,有媒體報道稱,騰訊微信事業群正在試運行“1065”工作制,即早上10點上班,晚上6點下班,一周...
-
南寧城投10億中票將付息 利率4.57%
觀點網訊:2月18日,據北京金融交易所披露,南寧城市建設投資集團有限責任公司發布2019年度第一期中期票...
-
融信4.21億出售寧波項目公司予海亮集團
觀點網訊:2月18日,融信中國控股有限公司發布公告稱,出售寧波項目予海亮集團,代價4 21億元。據悉,...
-
晉江城投完成發行20億元超短期債券 利率2.55%
觀點網訊:2月18日,據北京金融資產交易所顯示,福建省晉江城市建設投資開發集團有限責任公司披露了超短...
-
金科股份回售2020年公司債 涉及金額18.9億元
觀點網訊:2月18日,金科地產集團股份有限公司披露有關20金科01回售結果。根據《金科地產集團股份有限公...
-
金科股份19億元公司債券將付息 票面利率6.0%
觀點網訊:2月18日,金科地產集團股份有限公司披露2020年面向合格投資者公開發行公司債券(第一期)(品種...
-
特發服務:南通三建持有股份將被二次司法拍賣
觀點網訊:2月18日,深圳市特發服務股份有限公司發布關于公司持股5%以上股東股份將被司法拍賣的進展公告...
-
深交所:本周對近期漲幅異常的“浙江建投”“杭州園林”進行重點監控
深交所發布本周監管動態,2月14日至2月18日,本所共對43起證券異常交易行為采取了自律監管措施,涉及盤...
-
上海張江擬發行15億元中期票據 用于償還借款
觀點網訊:2月18日,上海張江(集團)有限公司擬發行2022年度第一期中期票據。據悉,該期票據注冊金額人...
-
澳門鋪市去年僅392買賣成交 同比增15%
觀點網訊:2月18日,據澳門統計暨普查局的統計數據顯示,2021年1至12月,市場合共累錄392宗商鋪物業買賣...
-
賽元生物完成新一輪近億元融資,加速iPSC衍生的通用型細胞藥物臨床研究
2022年02月16日,賽元生物科技(杭州)有限公司(簡稱:賽元生物)宣布完成新一輪近億元融資。本輪融資...
-
【經緯下午茶】A股董事長“老齡化”?14位八旬老人奮戰在一線
【熱點要聞】官方:做好鐵礦石、化肥等重要原材料和初級產品保供穩價十二部門通知要求,做好鐵礦石、化...
-
這家銀行行長請辭
在擔任華夏銀行行長近5年時間后,近日,華夏銀行執行董事、行長張健華宣布辭職。據悉,在董事會聘任新任...
-
2023年亞洲杯足球場館主體落成 預計年底竣工
今天,作為2023年亞洲杯比賽足球場館的廈門白鷺體育場,屋蓋鋼結構順利合龍,屋蓋鋼結構巨拱支撐胎架最...
-
新年新突破 上海浦東重大交通項目又有新進展
記者2月18日獲悉,在上海浦東新區,重大交通項目新年跑出了“引領區”加速度,有了新的進展。 機場聯...
-
大股東陽光集團披露陽光城境外債違約情況 涉及資金2726萬美元
觀點網訊:2月18日,福建陽光集團發布子公司陽光城境外附屬公司債務相關情況的公告。早前陽光城通過境外...
-
迅雷“潮好玩計劃”數字藏品超額預約 今日正式開搶
2月18日下午16時,迅雷“潮好玩計劃”數字藏品正式開售。此次售出藏品共5款,分別為賽博鳥、探索鳥、極...
-
十二部門:將2021年四季度實施的制造業中小微企業延緩繳納部分稅費政策延續實施6個月
十二部門:將2021年四季度實施的制造業中小微企業延緩繳納部分稅費政策延續實施6個月發改委等十二部門聯...
-
發改委:引導外賣等互聯網平臺企業進一步下調餐飲業商戶服務費標準
金融界2月18日消息發改委等多部委印發《關于促進服務業領域困難行業恢復發展的若干政策》。政策提出,引...
-
國家發展改革委等14部門:2022年暫停航空運輸企業預繳增值稅一年
國家發展改革委等14部門印發《關于促進服務業領域困難行業恢復發展的若干政策》,通知指出,2022年暫停...
-
遼寧省將開展危化品安全風險集中治理
為進一步有效防范化解危險化學品重大安全風險,保障人民群眾生命財產安全和社會穩定,近日,遼寧省印發...
-
全球最大100MW級全釩液流電池儲能調峰電站開始單體模塊調試
原標題:為大規模儲能在電力調峰中的應用提供大連力量 全球最大100MW級全釩液流電池儲能調峰電站開始...
-
遼寧自貿試驗區大連片區推出“海淘管家”服務模式
記者2月17日獲悉,為進一步滿足跨境電商市場主體的多元發展需求,遼寧自貿試驗區大連片區推出跨境電商“...
-
黑龍江:“技術加持”全省大豆擴種攻堅戰
原標題:今年將新增種植面積1000萬畝以上,制定大豆生產技術指導意見 “技術加持”全省大豆擴種攻堅...
-
今年吉林省計劃完成生態修復250萬畝
記者從2月17日上午召開的全省林業和草原工作會議獲悉,2022年,吉林省將以優化連通森林、草原、濕地“三...
-
融資丨「愛聽科技」完成數千萬元A輪融資,晨壹投資獨家投資
創業邦獲悉,2月18日,中高端助聽器生產商愛聽科技宣布已完成數千萬元A輪融資,本輪融資由晨壹投資獨家...
-
青島查處一起涉違法失德藝人吳某凡網絡視聽案
中新經緯2月18日電“青島文化執法”微信號日前通報,查處一起涉違法失德藝人吳某凡網網絡視聽案,涉案網...
-
融資丨「橙氧科技」完成數千萬元A輪融資
創業邦獲悉,2月18日,電力多元化轉換(Power-to-X)技術及化學品現場生產設備商橙氧科技宣布完成數千萬...
-
融資丨「純鈞新材料」一年內完成億元三輪融資
創業邦獲悉,2月18日,純鈞新材料(深圳)有限公司(以下簡稱:純鈞)宣布了在一年內完成的億元三輪融資...
-
擬出資680萬建子公司,成立不足半年被注銷,步長制藥意欲何為?
中新經緯2月18日電(王玉玲)近日,山東步長制藥(603858,診股)股份有限公司(下稱步長制藥)發布關于注銷全...
-
成都明確文創產業發展“規劃圖” 2025年文創產業增加值突破3000億元
“預計到2025年,成都文創產業增加值將突破3000億元,占全市GDP比重超過12%。”這是2月16日下午記者從成...
-
成都通用航空產業園項目集中簽約
協議總投資35億元涉及航空應急救援、運營服務等領域 2月17日,成都通用航空產業園項目集中簽約儀式在...
-
1月中國運輸生產指數發布:貨運指數小幅下降、客運指數降幅收窄
交通運輸部科學研究院18日發布的中國運輸生產指數(CTSI)顯示,1月CTSI指數總體呈現“貨運小幅下降、客...
-
江西省加緊開展豬肉收儲保障市場平穩 去年底全省生豬存欄1683.2萬頭
近日,國家發改委監測數據顯示,全國平均豬糧比價進入過度下跌二級預警區間,國家將視情啟動豬肉儲備收...
-
廣西林業崛起千億元產業集群
一產多個領域全國第一,二產產值超過三千億元,三產方興未艾后勁十足 廣西林業部門的年度統計第二產...
-
山東省級財政統籌資金8億元支持春季農業生產 促進小麥苗情由弱轉壯
記者代玲玲實習生胡方琦通訊員孟燦 記者從省財政廳獲悉,為支持春季農業生產,省級財政統籌資金8億元...
-
柳州螺螄粉企業吹響復工“集結號”
春節剛過,柳州螺螄粉產業園就全面吹響復工“集結號”,奮力奪取“開門紅”。 2月16日,記者來到柳州...
-
融資丨「朝上科技」完成千萬元天使輪融資,紅杉中國種子基金獨家投資
創業邦獲悉,2月17日,磁流變智能懸架整體方案供應商朝上科技宣布已完成千萬元天使輪融資。本輪融資由紅...
-
萬億市值的寧德時代,只是冰山一角
一座座充換電站終將迅速蔓延,如雨點落在湖面,泛起漣漪點點,最終匯聚,浪潮漸起。全文4978字,閱讀約...
-
午評:創業板指半日跌近1% 大數據概念股掀漲停潮
11:31【午評:創業板指半日跌近1%大數據概念股掀漲停潮】財聯社2月18日電,指數上午走勢分化,上證指數...
-
宋都退地后地塊重新上架 或將于杭州2022年首批集中供地出讓
觀點網訊:2月16日晚間,杭州運河集團建設管理有限公司官微披露,杭州市土地儲備交易中心已完成對運河新...
-
百度Apollo:“蘿卜快跑”自動駕駛出行服務落地深圳
金融界2月18日消息,2月17日,百度Apollo自動駕駛出行服務平臺「蘿卜快跑」正式落地深圳市創新高地——...
-
谷歌擬追隨蘋果 推新隱私保護政策
據法新社報道,繼去年蘋果公司推行新隱私政策減少對其IOS操作系統中的應用追蹤后,當地時間2月16日,谷...
-
49元一節團操課 Keep推出“優選健身館計劃”
2月18日,運動科技公司Keep宣布全面升級與傳統健身房的合作,推出Keep優選健身館計劃。據悉,自2月21日...
-
香港深水埗南昌街165號全幢物業1.7億港元標售
觀點網訊:2月18日,中原(工商鋪)商鋪部表示,以招標形式出售深水埗南昌街165號全幢物業,截標日期為3月...
-
臺州溫嶺市成交1宗商住用地 溢價率14.54%
觀點網訊:2月18日,臺州溫嶺市出讓1宗商住地,經過54輪競價,溫嶺柏澳房地產有限公司以總價8348萬元競...
-
浙江省“無廢城市”建設再提升
日前,浙江發布2021年度“無廢指數”——76 4。相比去年11月“無廢指數”首發時的76 17,穩中有升。其...
-
上海申通地鐵擬轉讓廣沅置業50%股權
觀點網訊:2月17日,上海聯合交易所披露,上海申通地鐵資產經營管理有限公司擬轉讓全資子公司上海廣沅置...
-
美聯:港逾5000萬港元豪宅新盤銷售宗數按年逆市升
觀點網訊:2月18日,第五波疫情爆發,發展商觀望后市,導致本年迄今新盤銷售宗數減少,對比去年同期更按...
-
安徽非營利性民辦學校收費管理辦法出臺 民辦學校辦學成本支出要對外公開
非營利性民辦學校收費也要嚴格遵守規定,不可“任性收費”。記者2月15日從省發展改革委獲悉,近日,省發...
-
央視新聞、天眼查聯合出品紀錄片《中國暖流》火熱開播
新春的腳步還沒遠去,不同地區的人們,早就為自己的事業提前踏上征程。在這樣熱火朝天的奮斗氛圍中,2月...
-
福建:海洋經濟產融合作簽約超200億元
17日,全省海洋經濟項目融資對接會在福州舉行。省投資集團、省船舶集團、省旅發集團等多家企業與金融機...
-
北京居民1月份消費價格環比上漲0.2% 居住價格上漲1.6%
觀點網訊:2月18日,國家統計局北京調查總隊發布2022年1月份北京居民消費價格變動情況。2022年1月份,北...
-
2021年我國石化行業營業收入和利潤總額創新高
08:27【2021年我國石化行業營業收入和利潤總額創新高】財聯社2月18日電,中國石油和化學工業聯合會昨天...
-
中信證券:“東數西算”全面啟動 建議關注IDC產業鏈
08:30【中信證券:“東數西算”全面啟動建議關注IDC產業鏈】財聯社2月18日電,中信證券指出,國家發改委...
-
人勤春來早,春耕備耕忙 高質量春耕保障糧食安全
“現在的天氣,土軟好翻而且不曬,非常適合進行春耕備耕工作。”全國種糧大戶、汕頭市錦灃合作社理事長...
-
美聯儲鷹派高官布拉德:通脹或將“失去控制” 現在急需采取行動
美東時間2月17日晚間,“美聯儲最鷹”布拉德JamesBullard在接受CNN采訪中指出,量化寬松將在3月結束,并...
-
新能源重卡1月銷量暴增滲透率上升到7.5%
電動化浪潮滾滾而來,電動重卡車的市場也在迅速打開。最新的交強險終端銷量數據顯示,2022年1月,國內新...
-
上海臨港城投一宗地塊規劃公示 擬建24幢高層住宅、2幢保障房
觀點網訊:近日,上海自貿區臨港新片區海灣板塊內1宗地塊發布規劃公示,擬建26幢高層商品住宅和保障房。...
-
國家體育總局:中國已實現 “帶動三億人參與冰雪運動”目標
2月17日,在2022北京新聞中心新聞發布會上,國家體育總局、國家統計局、北京市體育局相關負責人介紹了北...
-
黃金“王者歸來” 創一個月最大日漲幅 美國債價格反彈、收益率齊降
俄烏局勢引發市場避險情緒,現貨黃金盤中大漲,一度突破1900美元大關。COMEX4月黃金期貨收漲1 6%,創1...
-
匯能集團與馬來西亞州政府機構合作實現綠色計劃
觀點網訊:2月18日,匯能集團控股國際有限公司發布自愿公告稱,與馬來西亞州政府機構合作實現綠色計劃。...
-
購房成本漸增或為美國樓市降溫
在線地產銷售平臺Zillow公布的美國房屋價值指數顯示,去年12月美國房屋價值較11月上漲1 4%,至32 0662...
-
監管層連續出手摁住“瘋狂的石頭”
兩部門對鐵礦石市場開展監管調研,鐵礦石主力合約本周前四個交易日累計跌幅約為18% 國家發展改革委2...
-
千億房企又爆雷了!1.7億利息還不上,下月有本金到期
繼境內債出現利息展期和違約不到20天,千億“閩系”陽光城(000671,診股)規模更大的境外債出現利息違約。...
-
財聯社2月18日電,美聯儲梅斯特稱,如果通脹沒有緩解,可以在下半年加快收縮步伐。
06:08財聯社2月18日電,美聯儲梅斯特稱,如果通脹沒有緩解,可以在下半年加快收縮步伐。
-
資金支出截止日來臨 美國政府再次面臨關門危機
06:09【資金支出截止日來臨美國政府再次面臨關門危機】財聯社2月18日電,當地時間2月18日將是美國國會參...
-
國內成品油價格繼續上調 業內預計下一輪調價有望沖擊“五連漲”
06:30【國內成品油價格繼續上調業內預計下一輪調價有望沖擊“五連漲”】財聯社2月18日電,自2022年2月17...
-
近40家公司提示股東被動減持 平倉風險舊患引來新問題
06:27【近40家公司提示股東被動減持平倉風險舊患引來新問題】財聯社2月18日電,今年以來,滬深兩市共有...
-
躍躍御市:合資股比放開,"弱勢"跨國車企能否逆勢翻盤?
通過增加股比,投入更多資源,目前暫處“弱勢”的跨國車企或許能夠改變在華的命運。只不過,中國汽車市...
-
俄外交部:存在與美方就轟炸機在邊界附近飛行問題達成一致的潛在可能
03:48【俄外交部:存在與美方就轟炸機在邊界附近飛行問題達成一致的潛在可能】財聯社2月18日電,俄羅斯...
-
財聯社2月18日電,惠譽稱尚未觀察到奧密克戎毒株對美國就業統計數據的顯著影響,大多數州的經濟穩步增長。
財聯社2月18日電,惠譽稱尚未觀察到奧密克戎毒株對美國就業統計數據的顯著影響,大多數州的經濟穩步增長...
-
財聯社2月18日電,巴西報告新增131049例新冠肺炎確診病例,新增1128例死亡病例。
此頁面是否是列表頁或首頁?未找到合適正文內容。
-
財聯社2月18日電,COMEX 4月黃金期貨收漲1.6%,報1902美元/盎司。
此頁面是否是列表頁或首頁?未找到合適正文內容。
-
美國總統拜登的國情咨文將重點談經濟和通貨膨脹
04:09【美國總統拜登的國情咨文將重點談經濟和通貨膨脹】財聯社2月18日電,美國民主黨參議員查克·舒默...
-
標普500指數跌幅擴大至2%
04:10【標普500指數跌幅擴大至2%】財聯社2月18日電,美股持續走低,標普500指數跌幅擴大至2%,納指現跌2...
-
伊朗外交部發言人否認媒體爆料的伊核談判協議 并稱其與實際信息大不相同
04:24【伊朗外交部發言人否認媒體爆料的伊核談判協議并稱其與實際信息大不相同】財聯社2月18日電,針對...
-
美股收盤三大指數低開低走 科技股普跌
05:00【美股收盤三大指數低開低走科技股普跌】財聯社2月18日電,美股收盤三大指數低開低走,道指跌1 78...
-
財聯社2月17日電,阿迪達斯預計2022年中國業務將增長。
此頁面是否是列表頁或首頁?未找到合適正文內容。
-
高凌信息獨董兼職隱而未宣 昔日代持股東“輾轉”合作方利益鏈或存交織
《金證研》北方資本中心池淵 作者巫恩映蔚 風控股權代持,作為以該他人名義代實際出資人并履行股東權...